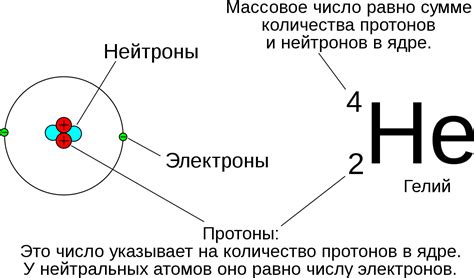
Ядро атома является его основной частью, содержащей производные от нейтронов и протонов. Количество этих частиц в ядре характеризует химические свойства элемента. Все элементы упорядочены в таблице элементов – основном справочнике химика. Различные свойства элементов можно понять, изучив их ядро и количество нейтронов и протонов в нем.
Протоны положительно заряжены и определяют атомный номер элемента. Чтобы найти количество протонов, просто посмотрите на атомный номер элемента в таблице. Нейтроны не имеют заряда, но они находятся в ядре и способствуют его устойчивости. Чтобы узнать количество нейтронов, нужно вычесть количество протонов из атомного веса элемента.
Изучение ядра атома является одной из основных задач физики и химии. Качественное представление о составе ядра помогает исследовать химические и физические превращения вещества, а также разрабатывать новые материалы и технологии. Используя таблицу элементов и данные о количестве протонов и нейтронов, ученые могут определить свойства элементов, их способность к синтезу и распаду, исследовать ядерные реакции и прогнозировать химические свойства новых веществ.
Таблица элементов: протоны и нейтроны в ядрах
Протоны - это элементарные частицы, обладающие положительным электрическим зарядом. Они находятся в ядре атома вместе с нейтронами, которые не имеют заряда. В данной таблице представлены протоны и нейтроны для каждого элемента.
Количество протонов определяет атомный номер элемента и уникальность каждого элемента. Например, у водорода (H) только один протон в ядре, а у углерода (C) - шесть протонов. Также, протоны влияют на химические свойства элемента.
Нейтроны, в свою очередь, не имеют электрического заряда и не влияют на химические свойства элемента. Они обеспечивают ядру атома стабильность и помогают бороться с отталкиванием протонов, так как протоны имеют одинаковый положительный заряд и могут отталкиваться друг от друга.
В таблице элементов указываются количество протонов, нейтронов и электронов. Каждый элемент имеет свое уникальное значение. Также в таблице указывается относительная атомная масса, которая является суммой протонов и нейтронов в ядре.
Таблица элементов является важным инструментом для научных исследований, а также для образования в области химии и физики. Она позволяет исследовать и классифицировать элементы по их физическим и химическим свойствам, что способствует развитию науки и прогрессу в области технологий.
Состав ядра атомов: протоны и нейтроны

Протоны и нейтроны имеют примерно одинаковую массу, которая называется ядерной массой. Масса протона составляет около 1,67262 x 10^-27 килограмма, а масса нейтрона - около 1,67493 x 10^-27 килограмма.
Количество протонов в ядре определяет атомный номер химического элемента и определяет его положение в периодической системе. Например, атом с одним протоном - это водород, атом с двумя протонами - гелий и так далее.
Количество нейтронов в ядре может варьироваться для одного и того же химического элемента. Варианты с разным количеством нейтронов называются изотопами. Изотопы могут иметь различные физические свойства, например, массу и стабильность.
Протоны и нейтроны: различия и функции
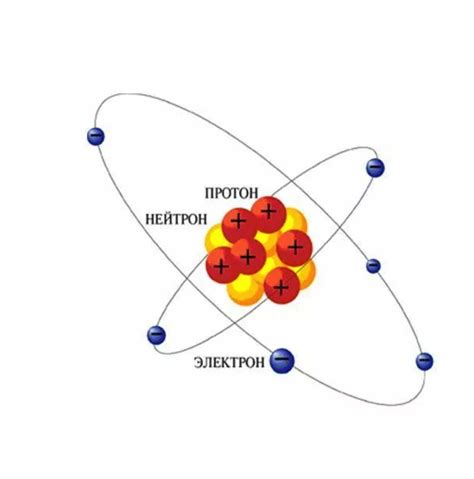
Протон - положительно заряженная элементарная частица, обозначаемая символом "p". Количество протонов в ядре определяет химические свойства атома и его порядковый номер в таблице Менделеева. Протоны притягивают электроны и создают электрическое поле, необходимое для стабильности атома.
Нейтрон - нейтральная элементарная частица, обозначаемая символом "n". Нейтроны не имеют электрического заряда и не взаимодействуют с электрическим полем. Однако, они являются ключевыми компонентами в ядре атома. Нейтроны помогают поддерживать стабильность ядра и предотвращают отталкивание протонов друг от друга.
Протоны и нейтроны взаимодействуют друг с другом и с электронами в атоме, обеспечивая его структуру и свойства. Без этих частиц атомы не смогли бы образовывать молекулы и все химические реакции были бы невозможны.
Вместе с электронами, протоны и нейтроны составляют основную часть массы атома. Поэтому, изучение свойств и функций этих элементарных частиц имеет важное значение для понимания вещества и его строения.
Понятие стабильности ядер: баланс протонов и нейтронов
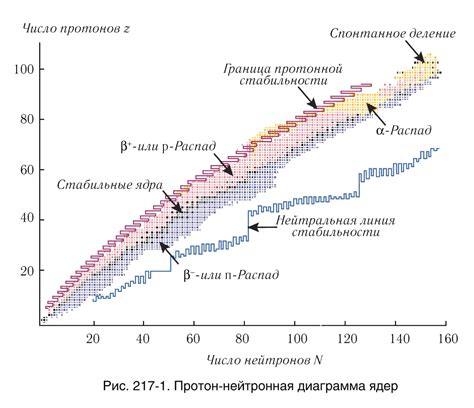
Ядро атома состоит из протонов и нейтронов, и их соотношение определяет стабильность ядра. Устойчивые ядра имеют определенное соотношение протонов и нейтронов, при котором энергетический баланс сохраняется.
Если количество протонов и нейтронов слишком мало, то ядро будет нестабильным и будет распадаться, ища более устойчивое состояние. Это явление известно как радиоактивность. Нестабильные ядра испускают частицы или излучение в процессе распада.
С другой стороны, если протонов и нейтронов слишком много, то также возникают проблемы с устойчивостью. Новые нуклоны начинают испытывать электростатическое отталкивание. При достижении критического значения, ядро становится нестабильным и начинает распадаться. Такие ядра обычно очень тяжелые и не существуют в природе.
Баланс протонов и нейтронов можно представить в виде графика, где по горизонтальной оси указано количество протонов, а по вертикальной - количество нейтронов. В области стабильности будут находиться точки, представляющие стабильные ядра. Внешние области графика представляют нестабильные ядра.
Изучение баланса протонов и нейтронов в ядрах помогает понять, какие ядра являются устойчивыми и какие нестабильными. Это имеет важное значение в ядерной физике и астрономии, а также в различных областях науки и технологий, связанных с использованием радиоактивных материалов и ядерной энергии.
Изотопы элементов: изменение количества нейтронов
Количество нейтронов в ядре изотопа может варьироваться в пределах определенного диапазона значений. Изменение количества нейтронов в ядре приводит к изменению массового числа атома, при этом химические свойства элемента при этом остаются неизменными.
Изотопы элементов отличаются друг от друга массовым числом, которое представляет собой сумму протонов и нейтронов в ядре атома. Например, углерод имеет известные нам трепетник, и каждый из них имеет различное количество нейтронов в ядре. Все изотопы выполняют ту же самую функцию, но в некоторых изотопах в количестве нейтронов является наиболее часто изменяющим фактором.
Примером явлений, связанных с изменением количества нейтронов в изотопах является атом бериллия, который имеет 4 известных изотопа. Бериллий-7 состоит из 4 протонов и 3 нейтронов, бериллий-9 - из 4 протонов и 5 нейтронов, а бериллий-10 и бериллий-11 также имеют различное количество нейтронов в ядре.
Благодаря изменению количества нейтронов в ядре, изотопы элементов могут обладать различными физическими свойствами, такими как стабильность, радиоактивность, возможность использования в медицине и промышленности.
Массовое число и атомный номер: отличие и значение
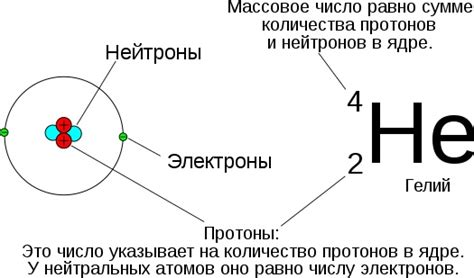
- Массовое число - это сумма протонов и нейтронов в ядре атома. Оно обозначается символом A и может принимать целочисленные значения. Массовое число является основным физическим параметром, определяющим массу атома. Количество нейтронов в ядре может варьироваться у атомов одного и того же элемента, и различные формы атомов с разным количеством нейтронов называют изотопами.
- Атомный номер - это количество протонов в ядре атома. Он обозначается символом Z и также является целочисленным значением. Атомный номер определяет положение элемента в периодической системе и определяет его уникальные свойства. Например, элемент с атомным номером 6 всегда будет быть углеродом, а атомный номер 1 соответствует водороду.
Массовое число и атомный номер являются важными параметрами для классификации и изучения элементов. Они позволяют определить химическую активность элемента, его атомную массу и другие свойства. Зная массовое число и атомный номер, можно предсказать ряд химических реакций, физические свойства элемента и его положение в периодической системе.
Таким образом, массовое число и атомный номер являются основными параметрами, определяющими свойства и поведение химических элементов. Они являются ключевыми для понимания и изучения мира микромасштабных частиц и являются основой для построения периодической системы элементов.
Положение элементов в таблице Менделеева: связь с количеством протонов

Количество протонов в ядре определяет атомный номер элемента, который отображается в таблице Менделеева. Атомный номер увеличивается по мере увеличения количества протонов. Так, элемент с атомным номером 1 имеет 1 протон в ядре, элемент с атомным номером 2 - 2 протона, и так далее.
В таблице Менделеева элементы расположены по возрастанию их атомных номеров, начиная с водорода (H) и заканчивая оганессоном (Og). Каждый следующий элемент имеет на единицу больше протонов, чем предыдущий.
Количество протонов в ядре влияет на электронную конфигурацию атома и его химические свойства. Элементы с одинаковым количеством протонов в ядре (например, элементы первой группы - литий, натрий, калий) обладают схожими свойствами и образуют вертикальные группы в таблице Менделеева.
С помощью таблицы Менделеева ученые могут легко определить положение элемента, исходя из его атомного номера (количества протонов) и значительно облегчить изучение его свойств и реакций.
Ядерные реакции: взаимодействие протонов и нейтронов
Ядерные реакции представляют собой процессы, при которых происходит взаимодействие протонов и нейтронов в ядрах атомов. Эти реакции имеют огромное значение не только для физики, но и для многих других научных и практических областей.
Протоны и нейтроны в ядрах образуют ядерные системы, которые могут быть стабильными или нестабильными. При взаимодействии протонов и нейтронов в ядре могут происходить различные ядерные реакции, такие как рассеяние, захват и испускание частиц, распад и синтез новых ядер.
В результате ядерных реакций могут образовываться ядра новых элементов, а также выделяться или поглощаться большое количество энергии. Это открывает широкие возможности для применения ядерных реакций в различных областях, таких как ядерная энергетика, медицина, производство радиоизотопов, научные исследования и другие.
Ядерные реакции являются основополагающими процессами в ядерной физике и имеют фундаментальное значение для понимания строения и свойств ядер. Их изучение позволяет расширять наши знания о Вселенной и основы макроскопической реальности, и является ключевым элементом в развитии науки и технологий будущего.