Для понимания того, сколько составляет 0,1 моль на один литр, необходимо обратиться к концепции нормальности - одной из основных величин, используемых в химии. Нормальность (N) определяет количество эквивалентов растворенного вещества в одном литре раствора. Эквивалент в химии, в свою очередь, означает количество вещества, которое может вступить в химическую реакцию с другими веществами.
Таким образом, если мы имеем 0,1 моль дм3 раствора, то нам нужно определить количество вещества, которое оно представляет в эквивалентах. Для этого необходимо знать молярную массу растворенного вещества. После этого можно легко перейти от молей к эквивалентам, используя соответствующие коэффициенты окисления и валентность вещества.
Другими словами, 0,1 моль дм3 раствора будет иметь разную нормальность для разных веществ, так как коэффициенты окисления и валентность могут отличаться. Поэтому без указания конкретного вещества невозможно точно сказать, сколько составляет 0,1 моль дм3 в нормальности.
Сколько нормальности составляет 1 моль в 1 дм³?

Если в растворе содержится 1 моль активного вещества в 1 дм³ раствора, то раствор имеет нормальность 1 Н.
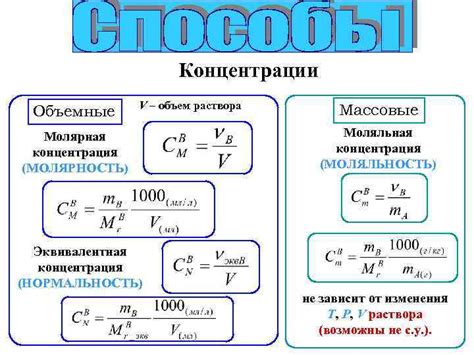
Нормальность можно выразить формулой:
N = c × V
где N - нормальность, c - концентрация вещества в молях на литр, V - объем раствора в литрах.
Таким образом, если в растворе содержится 1 моль вещества в 1 дм³ раствора, то его нормальность будет равна 1 Н.
Нормальность и моль

Моль - это единица измерения количества вещества. Она определяется как количество вещества, содержащееся в системе, которая содержит столько же элементарных единиц (атомов, молекул и т. д.), сколько содержится в 12 г атомов углерода-12. Моль используется для измерения количества вещества и его массы.
Нормальность - это концентрация вещества в растворе, выраженная в эквивалентах этого вещества на объем раствора. Нормальность может быть определена, зная количество вещества и общий объем раствора. Нормальность позволяет сравнивать концентрации различных веществ в растворе и выполнять расчеты химических реакций.
Чтобы перевести концентрацию раствора из моль/л в нормальность, нужно знать количество активных групп вещества в реакции. Для этого можно использовать формулу:
Нормальность = концентрация вещества (моль/л) * количество активных групп вещества.
Таким образом, если у нас есть раствор с концентрацией 0,1 моль/л и количество активных групп вещества равно 1, то его нормальность будет равна 0,1 ноль.
Коэффициент нормальности

Для того чтобы вычислить коэффициент нормальности, нужно знать молярную концентрацию вещества, выраженную в молях на литр (моль/л), и степень его диссоциации или ассоциации. Коэффициент нормальности определяется следующей формулой:
Н = m/M × α
где:
- Н – коэффициент нормальности
- m – молярная концентрация вещества (моль/л)
- M – молярная масса вещества (г/моль)
- α – степень диссоциации или ассоциации
Коэффициент нормальности позволяет сравнивать концентрации разных растворов по количеству активных частиц. Например, если у двух растворов одинаковая молярная концентрация, но разная степень диссоциации, то коэффициент нормальности будет разным.
Зная коэффициент нормальности, можно проводить расчеты в реакциях и определять необходимое количество реагента для достижения определенного результата.
Подсчет нормальности из молярности и объема
Если даны молярность раствора и его объем, нормальность может быть рассчитана с использованием следующей формулы:
Нормальность (N) = Молярность (M) * Эквивалентность (E)
Эквивалентность - это количество реактивных групп в молекуле вещества, которые могут вступать в химическую реакцию.
Чтобы рассчитать нормальность, необходимо знать эквивалентность растворенного вещества. Эквивалентность может быть найдена по схеме реакции или указана в химической формуле вещества.
Пример:
| Молярность (M) | Объем (V) | Эквивалентность (E) | Нормальность (N) |
|---|---|---|---|
| 0,1 моль/л | 1 л | 1 эквивалент | 0,1 нормальность |
| 0,5 моль/л | 2 л | 2 эквивалента | 1 нормальность |
Таким образом, для перевода молярности раствора в нормальность необходимо умножить молярность на эквивалентность растворенного вещества.
Примеры расчета нормальности

Пример 1: Calculating Normality using Molarity.
Дано: Molarity (M) = 0.5 M, Volume (V) = 1 L
Решение:
- Найдем количество вещества в молях, используя уравнение Моль = Молярность × Объем:
- Найдем эквивалентность, используя уравнение Эквивалентность = Моль × Степень диссоциации:
Моль = 0.5 M × 1 L = 0.5 моль
Эквивалентность = 0.5 моль × 1 = 0.5 экв.
Ответ: Нормальность (N) = 0.5 N
Пример 2: Calculating Normality using Mass.
Дано: Mass (m) = 10 g, Molecular Weight (Mw) = 20 g/mol, Volume (V) = 500 mL
Решение:
- Найдем количество вещества в молях, используя уравнение Моль = Масса / Молярная масса:
- Найдем эквивалентность, используя уравнение Эквивалентность = Моль × Степень диссоциации:
- Переведем объем в литры:
- Найдем нормальность, используя уравнение Нормальность = Эквивалентность / Объем:
Моль = 10 g / 20 g/mol = 0.5 моль
Эквивалентность = 0.5 моль × 1 = 0.5 экв.
Объем = 500 mL ÷ 1000 = 0.5 L
Нормальность = 0.5 экв. / 0.5 L = 1 N
Ответ: Нормальность (N) = 1 N
Эти примеры демонстрируют основные шаги для расчета нормальности раствора, используя молярность и массу вещества. Расчет нормальности имеет важное значение в аналитической химии и позволяет получить информацию о количестве активных частиц в растворе.