Металлы – это класс веществ, которые обладают высокой теплопроводностью, электропроводностью, блестящей поверхностью и способностью приобретать положительный заряд. Однако, несмотря на это, металлы обычно не проявляют свойства окислителей. Отсутствие окислительных свойств металлов можно объяснить их особым строением и электронной структурой.
Металлы состоят из сетки положительно заряженных ионов, окруженных облаком свободных электронов. Это облегчает передачу электронов во внешнюю оболочку, что обеспечивает металлам низкую электроотрицательность и высокую электропроводность. Кроме того, свободные электроны в металлах обладают высокой подвижностью, что обусловливает их способность проводить ток.
Важно отметить, что металлы имеют слабее окислительные свойства по сравнению с неметаллами. Это связано с их способностью отдавать электроны и образовывать положительные ионы. В реакциях окисления, металлы обычно теряют электроны и становятся оксидами.
Кроме того, внешняя оболочка атомов металлов обычно имеет малое количество электронов, поэтому металлам выгоднее отдавать электроны, чтобы достичь стабильной октетной конфигурации и уменьшить свою энергию. Другими словами, металлы хотят стать электронадонышами, а не электроакцепторами.
Причины непроявления окислительных свойств металлов
Металлы имеют свойство не проявлять окислительные свойства, что делает их незаменимыми материалами во многих областях науки и техники. Существует несколько причин, по которым металлы не проявляют окислительные свойства, включая:
1. Образование защитной пленки. При взаимодействии с кислородом воздуха металлы образуют на своей поверхности тонкую защитную пленку оксида. Эта пленка предотвращает дальнейшее окисление металла и защищает его от дальнейшего взаимодействия с окружающей средой. Например, алюминий покрывается пленкой оксида алюминия, которая защищает его от дальнейшего окисления.
2. Положительный потенциал окисления. Металлы обладают положительным потенциалом окисления, что означает, что они имеют тенденцию уступать электроны в окислительные реакции. Этот положительный потенциал делает металлы стабильными в окислительных условиях и предотвращает их активное взаимодействие с окислителями.
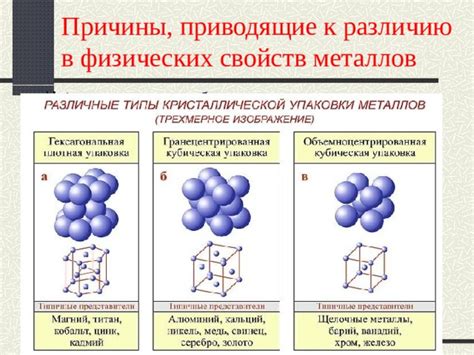
3. Структура кристаллической решетки. Металлы обладают определенной структурой кристаллической решетки, которая обеспечивает их стабильность и сопротивляемость окислению. Благодаря этой структуре, металлы сохраняют свои химические и физические свойства и не проявляют окислительные свойства.
В целом, эти свойства металлов объясняют их высокую химическую и термическую стабильность, а также их широкое применение в различных сферах науки и технологии.
Структура атома
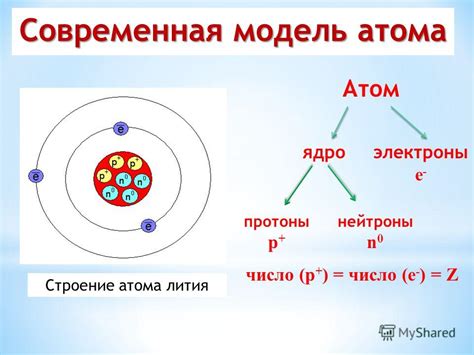
Основные электроны находятся на различных энергетических уровнях, называемых энергетическими оболочками. Каждая оболочка может содержать определенное количество электронов. Первая оболочка может содержать до двух электронов, вторая - до восьми и так далее.
В металлах внешняя энергетическая оболочка обычно содержит от одного до трех электронов. Такие атомы стремятся сфомировать полную оболочку, добавляя или отдавая электроны. В результате металлы образуют ион положительного заряда (катион) и выделяют электроны, которые становятся свободными. Свободные электроны в металлах образуют так называемие электронный газ, который может проводить электрический ток.