Индикаторы - это вещества, которые используются для измерения pH-значения растворов кислот и оснований. Они помогают определить, является ли раствор кислотным, щелочным или нейтральным. Обычно индикаторы изменяют цвет в зависимости от pH-значения раствора.
Цвет изменяется из-за разных химических свойств индикаторов. Когда раствор кислоты проходит через изменение pH, взаимодействие индикатора с кислотными и основными частичками приводит к изменению его структуры. В результате это вызывает и изменение цвета.
Например, фенолфталеин - один из наиболее используемых индикаторов. Он является бесцветным в кислых растворах и приобретает ярко-розовый цвет в щелочных растворах. Это происходит из-за химической реакции между фенолфталеином и щелочными ионами, которая приводит к образованию окрашенного соединения.
Другие индикаторы, такие как лакмус, бромтимоловый синий и универсальный индикатор, также меняют цвет в соответствии со своими химическими свойствами. Разные индикаторы имеют различные диапазоны изменения цвета, что позволяет им обнаруживать различные pH-значения.
Использование индикаторов в химических лабораториях и повседневной жизни помогает определить pH-значение растворов без использования сложного оборудования. Индикаторы - это надежные средства для определения кислотности или щелочности растворов, и их изменение цвета при изменении pH является основой их работы.
Изменение цвета индикаторов в растворах кислот и оснований
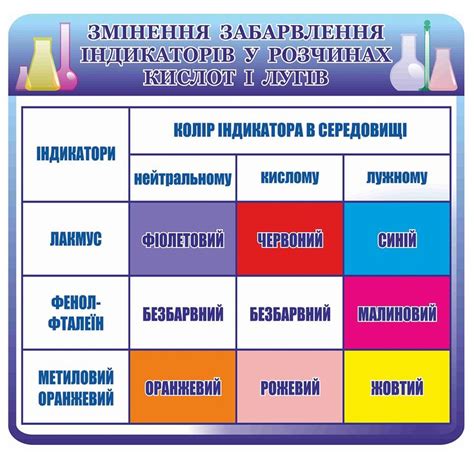
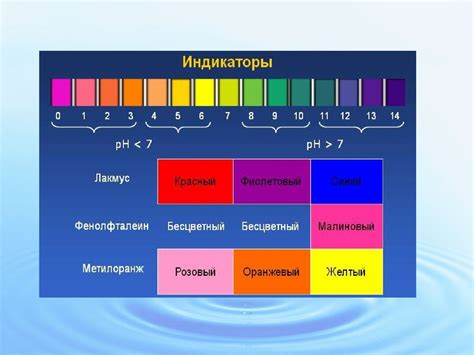
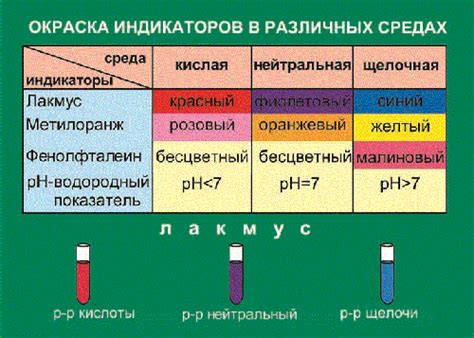
Для определения pH раствора широко используется несколько популярных индикаторов, таких как фенолфталеин, лакмус, метилоранж и бромтимоловый синий.
| Индикатор | Кислотный раствор | Основной раствор | Нейтральный раствор |
|---|---|---|---|
| Фенолфталеин | Бесцветный | Красный | Бесцветный |
| Лакмус | Красный | Синий | Пурпурный |
| Метилоранж | Красный | Желтый | Красный |
| Бромтимоловый синий | Желтый | Синий | Зеленый |
Когда индикатор вступает в реакцию с кислотной или щелочной средой, его молекулы изменяют свою структуру и переходят в различные формы, которые имеют разный цвет. У каждого индикатора есть свой диапазон pH, в пределах которого он меняет свой цвет. Например, фенолфталеин становится красным при pH выше 8, а лакмус краснеет в кислых условиях и становится синим в щелочных условиях.
Изменение цвета индикаторов в растворах кислот и оснований может быть объяснено на основе теории Бронстеда-Лоури. В кислотных растворах происходит процесс диссоциации, где кислота отдает протон, а в щелочных растворах происходит обратный процесс, где вода принимает протон от основания. Изменение цвета индикаторов связано с изменением концентрации протонов в растворе и, следовательно, изменением pH.
Таким образом, изменение цвета индикаторов в растворах кислот и оснований является результатом реакции между индикатором и протонами, которая меняет структуру и цвет молекулы индикатора.
Физико-химические свойства индикаторов и их реакции с кислотами и основаниями
В зависимости от pH раствора, индикаторы могут находиться в разных формах: кислой, основной или нейтральной. В кислых растворах индикаторы принимают кислую форму, в щелочных - основную, в нейтральных - нейтральную. При взаимодействии с кислотами и основаниями происходит изменение окружающей среды и, как результат, изменение цвета индикатора.
Например, фенолфталеин, кислый индикатор, имеет кислую форму, окрашенную в бесцветный или светло-желтый цвет. В кислых растворах индикатор остается в своей кислой форме и цвет его не меняется. Однако, если в раствор добавить щелочь, pH повышается, и индикатор принимает основную форму, окрашенную в розовый цвет.
Другой пример - лакмус. Он является натуральным индикатором и имеет химическую структуру, которая позволяет ему менять цвет в зависимости от pH. В кислых растворах лакмус окрашен в красный цвет, а в щелочных - в синий или фиолетовый. При этом, если добавить кислоту в щелочный раствор с лакмусом, он мгновенно изменит свой цвет обратно на красный.
Таким образом, физико-химические свойства индикаторов и их реакции с кислотами и основаниями связаны между собой и определяют возможность использования индикаторов для определения pH раствора. Понимание этих свойств помогает ученым и химикам в процессе анализа и определения кислотности или щелочности различных веществ и сред.
Влияние изменения pH на дикотомическую систему индикаторов
Изменение pH в растворе может привести к изменению окраски индикатора, что позволяет наблюдать изменение степени кислотности или щелочности среды. Часто для определения pH используют дикотомическую систему индикаторов, которая позволяет быстро проконтролировать кислотность или щелочность раствора.
Дикотомическая система индикаторов основывается на применении двух индикаторов с различными цветами. Один из индикаторов обладает свойством изменять цвет в кислых условиях, а другой - в щелочных условиях.
Использование изменения цвета индикаторов в практических целях
Изменение цвета индикаторов в растворах кислот и оснований находит широкое применение в различных практических сферах. Данный эффект можно использовать для определения pH (кислотности или щелочности) раствора, контроля качества пищевых продуктов, медицинских исследований, а также в процессе химического анализа.
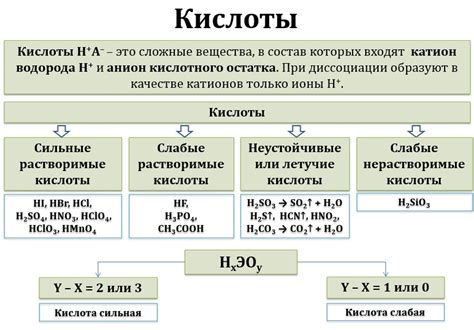
Кислоты и основания различаются по ионам, которые они выделяют в воде. Для изменения цвета индикаторов используются вещества, которые вступают в реакцию с этими ионами и образуют сложные соединения, которые имеют цветные формы.
Изменение цвета индикаторов основано на принципе изменения состояния окрашенного класса бромометрических соединений. Фенольфталеин – обратимый показатель нейтрализации. Кчк = 9.2. Фенольфталеин окрашен в слабокислых или безыонных растворах.
| Цвет изменения индикатора | Действие |
|---|---|
| Красный | Нейтральный раствор |
| Оранжевый | Слабокислые растворы (pH 3-6) |
| Желтый | Слабощелочные растворы (pH 7-9) |
| Фиолетовый | Сильноказанные растворы (pH > 9) |
Таким образом, использование изменения цвета индикаторов позволяет удобно определять pH раствора и контролировать его кислотность или щелочность. Это особенно важно в области пищевой промышленности, где pH играет важную роль в процессе консервации и приготовления пищевых продуктов.