Бензол, химическое соединение, известное своей ароматной природой, часто используется в промышленности в качестве растворителя и химического предшественника. Однако, когда речь идет о смешивании бензола с водой, включается принципиально разная химическая реакция, или, скорее, ее отсутствие. Подобное поведение двух веществ воздерживается от активной взаимодействия, и в данной статье мы обратимся к причинам этого явления.
Реакция между бензолом и водой является типичным примером того, как полюсные и неполярные соединения обходятся без взаимодействия. Вода, природно полюсна, в то время как бензол, благодаря своей углеводородной структуре, обладает неполярными свойствами. Различные структуры обуславливают несовместимость между двумя веществами, поэтому они не образуют раствор в воде. Вместо этого они остаются в виде двух отдельных слоев.
Это явление можно объяснить на уровне межмолекулярного взаимодействия воды и бензола. Вода взаимодействует друг с другом и с другими полюсными веществами, создавая межмолекулярные водородные связи. Бензол, в свою очередь, обладает инертностью в отношении воды из-за отсутствия полярных атомов. В результате, молекулы бензола и воды не могут образовывать водородные связи, что препятствует их смешиванию и реакции.
Физические свойства бензола и воды
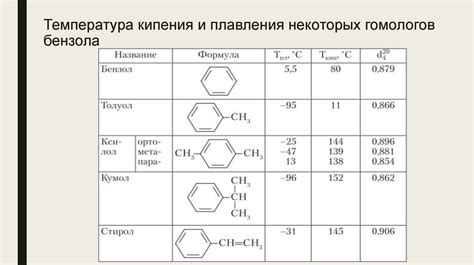
Вода, химическая формула H2O, является прозрачной жидкостью, которая играет роль растворителя для большинства веществ. Она имеет высокую плотность и тяжелее бензола, поэтому бензол не смешивается с водой и образует два разных слоя.
Таким образом, физические свойства бензола и воды играют важную роль в их взаимодействии. Несмотря на отсутствие химической реакции между бензолом и водой, их различные физические свойства определяют их поведение и нерастворимость друг в друге.
Ионизация воды и бензол

Процесс ионизации воды играет важную роль в химических реакциях, однако взаимодействие бензола с водой наблюдается с определенными трудностями.
Вода является полярной молекулой, что означает, что она имеет неравномерное распределение зарядов. Водные молекулы могут ионизироваться, образуя гидроксидные и ионные формы. Этот процесс может происходить по следующему уравнению:
2H2O → H3O+ + OH-
Таким образом, водная среда может предоставить положительно заряженные катионы H3O+ и отрицательно заряженные анионы OH-.
В свою очередь, бензол является неполярным органическим соединением и не может образовывать ионы воды. Бензол имеет структуру, которая не обладает зарядами и не способна на образование гидроксидных форм. Поэтому взаимодействие бензола и воды является труднореактивным процессом.
Тем не менее, это не означает, что бензол полностью нереактивен в отношении воды. Он может взаимодействовать с водой с помощью слабого межмолекулярного взаимодействия, известного как ван-дер-ваальсовы силы. Эти силы вызывают образование химического соединения, известного как солват, когда бензол окружен слоем водных молекул.
Итак, причиной отсутствия реакции между бензолом и водой является различие в их структуре и свойствах. Вода обладает полярными свойствами и способна ионизироваться, в то время как бензол является неполярным и не может образовывать ионы. Взаимодействие между бензолом и водой происходит за счет слабых ван-дер-ваальсовых сил, но не приводит к химической реакции.
Адсорбция и солватация
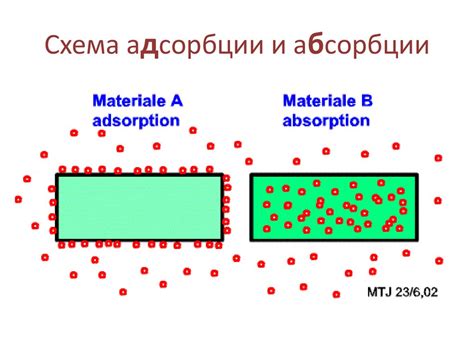
Адсорбция – это явление, при котором молекулы одного вещества (адсорбата) прилипают к поверхности другого вещества (адсорбента). В случае с бензолом и водой, адсорбция может происходить, например, на поверхности стекла или других материалов, которые контактируют с этими жидкостями.
Солватация, с другой стороны, представляет собой процесс, при котором молекулы одного вещества (солвента) окружают молекулы другого вещества (субстрата) и образуют вокруг них оболочку. В случае с бензолом и водой, солватация может происходить в том случае, если бензол растворяется в воде и образует раствор.
Главное отличие между адсорбцией и солватацией заключается в том, что адсорбция происходит на поверхности вещества, а солватация – в объеме. Эти процессы могут сопровождаться химическими реакциями или просто физико-химическими взаимодействиями.
Таким образом, понимание адсорбции и солватации может помочь в объяснении причин отсутствия реакции между бензолом и водой. Если бензол адсорбируется на поверхности материала, например, стекла, то он не сможет контактировать с водой в объеме и, следовательно, реакция не произойдет. С другой стороны, если бензол солватируется в воде и образует раствор, то реакция между ними может произойти.
Структурные особенности молекулы бензола
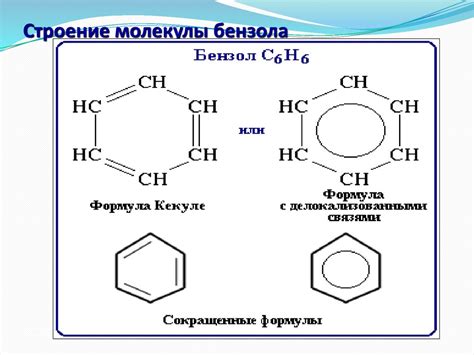
Каждый атом углерода в молекуле бензола находится в сп2-гибридизованном состоянии, что обеспечивает плоскую геометрию молекулы. Такая геометрическая структура обусловлена наличием пи-электронной системы, состоящей из 6 электронов, которая распределена над и под плоскостью кольца.
Пи-связи между атомами углерода в бензоле являются двойными связями, обладающими особым типом связи - ароматической связью. Это связь, которая электронно насыщена и очень стабильна, благодаря особенностям пи-электронной системы. В результате такой структуры, молекула бензола обладает высокой устойчивостью и реакционной инертностью.
Структурные особенности молекулы бензола определяют его химические свойства. Бензол часто используется в органической химии как растворитель, а также как исходный материал для синтеза различных органических соединений. Понимание структуры бензола помогает химикам объяснять и предсказывать его поведение в химических реакциях.
| Атом | Углерод (С) | Водород (H) |
|---|---|---|
| Количество атомов | 6 | 6 |
| Тип связи | Пи-связь | Сингл-связь |
| Гибридизация | Сп2 | Сп3 |
| Геометрическая структура | Плоская | Неопределенная |
Механизмы реакций между бензолом и водой
Молекула бензола (C6H6) является неополярной и имеет циклическую структуру. Вода (H2O), в свою очередь, является полярным соединением, обладающим дипольным моментом. Из-за этого различия в полярности, молекулы бензола и воды слабо взаимодействуют друг с другом.
Несмотря на это, некоторые реакции между бензолом и водой все же могут протекать. Например, при нагревании бензола с водой в присутствии катализатора, такого как серу это бензол может гидратироваться. В результате такой реакции молекула воды добавляется к молекуле бензола, образуя гидрат бензола (C6H6·H2O).
Другим возможным механизмом реакции между бензолом и водой является адсорбция. Бензол может адсорбироваться на поверхности воды, образуя тонкий пленку. Однако, в большинстве случаев, такая адсорбция не приводит к химической реакции между бензолом и водой, поскольку нет достаточного количества активных центров для инициирования реакции.
Таким образом, взаимодействие между бензолом и водой обусловлено различием в полярности молекул соединений. Несмотря на возможность реакции, она происходит очень медленно или требует использования специальных условий, таких как наличие катализатора. Понимание механизмов этих реакций позволяет лучше понять особенности взаимодействия бензола и воды и может быть полезным при проектировании химических процессов, связанных с этими веществами.
Влияние условий реакции на возможность взаимодействия бензола и воды
Одной из ключевых причин отсутствия реакции между бензолом и водой является различие в их полярности. Вода, являющаяся полярным растворителем, обладает полярной структурой вследствие наличия полярной связи между атомами кислорода и водорода. Бензол же, являющийся аполярным веществом, не содержит полярных связей и не имеет дипольного момента.
Как известно, полярные вещества легко растворяются в полярных растворителях, а аполярные - в аполярных. Именно поэтому бензол не может раствориться в воде без использования дополнительных факторов, таких как понижение температуры или добавление других веществ, способствующих растворению бензола в воде.
Важную роль в возможности взаимодействия бензола и воды играет также температура. При комнатной температуре бензол практически не растворим в воде. Однако, путем охлаждения смешанных веществ до очень низкой температуры, например, ниже 0°C, можно добиться равновесной реакции между бензолом и водой.
Следует отметить, что влияние условий реакции на возможность взаимодействия бензола и воды также может определяться добавлением других реагентов или использованием катализаторов. Например, добавление сильных кислот или щелочей может увеличить растворимость бензола в воде или даже способствовать образованию бензолсульфонатов или фенилатов.
Таким образом, хотя взаимодействие между бензолом и водой невозможно при обычных условиях, подходящие температурные или химические условия могут способствовать активации реакции между этими веществами. Все это указывает на важность учета и контроля условий реакции при изучении взаимодействия бензола и воды и дальнейшем исследовании их химических свойств.