Электролиты – это вещества, способные проводить электрический ток в растворенном состоянии. Они играют важную роль во многих процессах, связанных с протеканием электрических зарядов. Однако уровень проводимости электролитов может значительно изменяться в зависимости от их концентрации в растворах.
Проводимость электролитов возникает благодаря наличию ионов, которые обладают положительным или отрицательным зарядом. При наличии электрического поля ионы начинают двигаться в противоположных направлениях, создавая электрический ток. Именно концентрация этих ионов является основным фактором, влияющим на уровень проводимости электролитов.
С увеличением концентрации электролитов в растворе проводимость будет увеличиваться. Это объясняется тем, что большее количество ионов на единицу объема увеличивает вероятность их столкновений и, как следствие, увеличивает скорость их движения. При этом электрический ток будет проходить через раствор с большей интенсивностью.
Проводимость электролитов: основные понятия

Проводимость электролитов определяется ионной мобильностью и концентрацией ионов в растворе. Ионная мобильность характеризует способность иона перемещаться под воздействием электрического поля. Чем выше мобильность ионов, тем выше проводимость электролита.
Влияние концентрации на проводимость электролитов заключается в том, что при увеличении концентрации ионов в растворе, количество доступных для проведения электрического тока носителей заряда увеличивается. Это приводит к увеличению проводимости электролита.
| Концентрация | Проводимость |
|---|---|
| Низкая | Низкая |
| Средняя | Средняя |
| Высокая | Высокая |
Однако, при очень высоких концентрациях может происходить насыщение проводимости, так как ионы начинают между собой взаимодействовать и оказывать электростатическое влияние друг на друга, что затрудняет их перемещение и уменьшает проводимость.
Исследование проводимости электролитов и влияния концентрации на электрический ток имеет важное значение, особенно в области электрохимии, биологии и медицины. Понимание этих процессов позволяет разрабатывать эффективные методы лечения, а также улучшать процессы электролиза и химической синтеза.
Электролиты: что это и как они проводят электрический ток
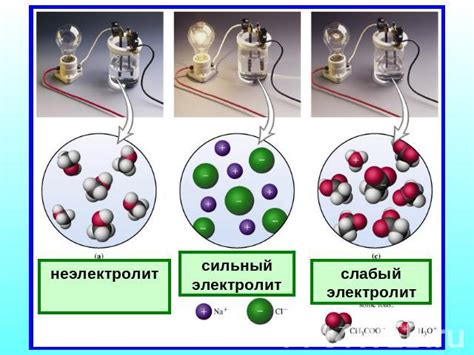
Сильные электролиты полностью диссоциируют в растворе, образуя положительные и отрицательные ионы. Примерами сильных электролитов являются соли, кислоты и щелочи. Когда электрический ток проходит через раствор с сильным электролитом, ионы с легкостью перемещаются к электродам, создавая электрический потенциал.
Слабые электролиты частично диссоциируют в растворе, образуя только небольшое количество ионов. Примером слабого электролита является уксусная кислота. При проведении электрического тока через раствор слабого электролита, только те ионы, которые диссоциировали, смогут перемещаться к электродам.
Концентрация электролита влияет на его проводимость. По мере увеличения концентрации электролита, количество ионов в растворе увеличивается, что приводит к увеличению проводимости. Это связано с тем, что большее количество ионов создает больше путей для передвижения электрического тока.
Для оценки проводимости электролитов в научных исследованиях используется проводимость электролита, которая измеряется в см/см. Процесс проведения электрического тока через электролиты является важным в множестве практических приложений, таких как электролитическая деполяризация, электрокомплексные реакции и использование электролитов в батарейках и аккумуляторах.
| Тип электролита | Примеры |
|---|---|
| Сильные электролиты | Соли, кислоты, щелочи |
| Слабые электролиты | Уксусная кислота, некоторые органические соединения |
Роль концентрации в проводимости электролитов
При увеличении концентрации электролита, количество свободных ионов в растворе также увеличивается. Ионы представляют собой заряженные частицы, способные находиться в движении под влиянием электрического поля. Следовательно, рост концентрации повышает вероятность столкновений между ионами, что способствует увеличению проводимости электролита.
В то же время, с увеличением концентрации электролита возникает эффект, называемый подавлением ионного движения электролита (ion suppression). При высоких концентрациях электролита в растворе ионы начинают взаимодействовать друг с другом, образуя ионные пары или агрегаты, которые слабо подвижны. Такое явление ограничивает возможность ионов перемещаться и снижает проводимость электролита.
Итак, концентрация электролита играет существенную роль в его проводимости. В некоторых случаях повышение концентрации приводит к увеличению проводимости, а в других - к ее снижению. Понимание зависимости между концентрацией и проводимостью электролита является важным фактором в различных областях науки и технологии, включая электрохимию, аналитическую химию, материаловедение и биологию.
Влияние концентрации на электрический ток

Концентрация влияет на электрический ток в электролите. Чем выше концентрация электролита, тем выше будет проводимость и ток. Концентрация определяет количество свободных ионов в растворе, которые могут переносить электрический заряд.
При увеличении концентрации электролита, количество свободных ионов также увеличивается, что приводит к увеличению количества переносимого электрического заряда. В результате, электрический ток через электролит увеличивается.
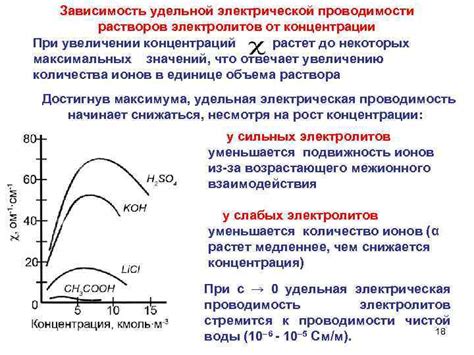
Однако, с увеличением концентрации электролита возникает эффект насыщения. Это связано с тем, что при большой концентрации ионов они начинают сталкиваться друг с другом, что затрудняет их движение и уменьшает электропроводность.
Таким образом, оптимальная концентрация электролита может обеспечить максимальную проводимость и ток. При дальнейшем увеличении концентрации, электрический ток может уменьшаться.
Зависимость проводимости от концентрации
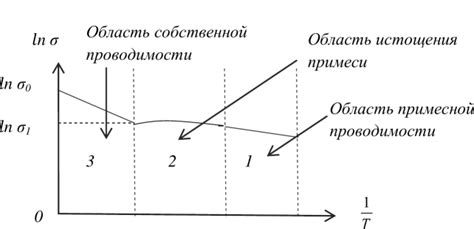
Проводимость электролитов непосредственно зависит от их концентрации в растворе. Известно, что чем больше количество электролита содержится в растворе, тем выше его проводимость электрического тока.
Концентрация электролита определяется как количество растворенного вещества, приходящееся на единицу объема раствора, и измеряется в молях на литр (М).
При низкой концентрации раствора число свободно двигающихся ионов меньше, что приводит к уменьшению проводимости электрического тока. С ростом концентрации электролита количество ионов увеличивается, что способствует увеличению проводимости.
Однако, при достижении определенной концентрации, называемой предельной концентрацией, проводимость электролита перестает зависеть от его концентрации и достигает насыщения. Предельная концентрация определяется взаимодействием ионов электролита с растворителем, и ее превышение не ведет к дальнейшему увеличению проводимости.
Таким образом, влияние концентрации электролита на его проводимость является нелинейным и учитывается при исследовании и применении электролитов в различных областях, включая химию, электрохимию и технологии энергосбережения.
Физические процессы, определяющие проводимость электролитов при разной концентрации

1. Ионизация и диссоциация
При добавлении электролита в воду или другой растворитель происходит процесс ионизации или диссоциации. В результате этого процесса образуются положительно и отрицательно заряженные ионы, которые способствуют проводимости электрического тока.
2. Мобильность ионов
Концентрация электролита влияет на мобильность его ионов. При низкой концентрации ионы свободно перемещаются и легко проводят электрический ток. При высокой концентрации ионов между ними возникают электростатические взаимодействия, что затрудняет их движение и снижает проводимость электролита.
3. Электродные реакции
При различной концентрации электролита на электродах происходят различные электродные реакции. При низкой концентрации они могут быть неполными или затрудненными, что снижает проводимость. При высокой концентрации возможно образование отложений на электродах, что также мешает проводимости.
Таким образом, физические процессы, определяющие проводимость электролитов при разной концентрации, включают ионизацию и диссоциацию, мобильность ионов и электродные реакции. Изменение концентрации электролита может значительно влиять на его проводимость и электрический ток.
Экспериментальные методы измерения проводимости
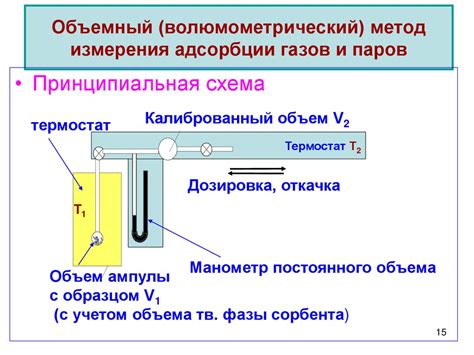
Для измерения проводимости электролитов, используемых в различных научных и технических областях, существуют различные экспериментальные методы. Они позволяют определить электрический ток, проходящий через электролит, и оценить его проводимость.
1. Метод электродной ячейки. В этом методе используется специальная ячейка, в которой помещается электролит. В ячейке находятся два электрода - рабочий и компенсационный. Рабочий электрод находится в электролите, а компенсационный - во внешней среде (например, воде). Измеряется разность потенциалов между электродами при пропускании через электролит электрического тока. Эта разность потенциалов позволяет определить проводимость электролита.
2. Метод проводимости в потоке. Этот метод основан на измерении проводимости электрической цепи, состоящей из электролита и электродов. С помощью измерительных приборов (например, мультиметра) определяется сила тока, проходящая через электролит при заданном напряжении. Затем проводимость рассчитывается по формуле, учитывающей длину и площадь электродов.
3. Метод омического сопротивления. В этом методе используется электролитическая ячейка, в которой измеряется истинная проводимость электролита. Происходит измерение напряжения и силы тока, проходящей через электролит, и по формуле рассчитывается его проводимость. Этот метод является наиболее точным и аккуратным для измерения проводимости электролитов.
Каждый из этих методов имеет свои преимущества и может быть применим в зависимости от конкретной задачи и требуемой точности измерения проводимости электролитов. От выбора метода также зависит сложность эксперимента и необходимое оборудование.
Применение проводимости электролитов в различных отраслях
Проводимость электролитов, являясь одной из основных характеристик, играет важную роль во многих областях. Различные отрасли современной науки и техники активно используют проводимость электролитов для достижения своих целей.
Одной из наиболее распространенных областей, где проводимость электролитов играет ключевую роль, является электрохимия. Проводимость электролитов позволяет эффективно проводить электролиз, электроосаждение металлов, электрохимическую синтез и другие процессы, связанные со взаимодействием веществ с электрическим током.
В медицине проводимость электролитов играет важную роль в диагностике и лечении различных заболеваний. Например, измерение уровня проводимости крови или мочи может служить для установления диагноза и контроля за состоянием пациента.
Проводимость электролитов также находит применение в производстве различных электронных устройств. Она позволяет обеспечивать надежную работу транзисторов, диодов и других элементов электронной схемы.
Еще одной областью, где проводимость электролитов играет важную роль, является сельское хозяйство. Использование электролитов и учет их проводимости позволяют оптимизировать состав почвы и внесение удобрений, что положительно сказывается на урожайности и качестве выращиваемых культур.
Научные исследования также активно используют проводимость электролитов. Она позволяет изучать различные электрохимические и физико-химические процессы, связанные с взаимодействием веществ с электрическим током.
В ходе проведенного исследования было выяснено, что концентрация электролита оказывает значительное влияние на его проводимость.
Увеличение концентрации электролита приводит к увеличению электрического тока, проходящего через раствор. Это связано с увеличением количества ионов, которые могут перемещаться в растворе и, следовательно, участвовать в проводимости.
Однако, при достижении определенной концентрации электролита, проводимость перестает линейно увеличиваться и достигает плато. Это объясняется насыщением раствора ионами, при которых все доступные для проводимости ионы уже заняты и дальнейшее увеличение концентрации не влияет на проводимость.
Также было замечено, что разные электролиты имеют различное влияние на проводимость при одинаковой концентрации. Это связано с разными характеристиками молекул и ионов в растворе, такими как заряд, размер и способность к образованию ионов.
Исследование проводимости электролитов является важным для понимания свойств растворов и их применения в разных областях, включая химическую промышленность, медицину и электрохимию. Результаты исследования позволяют оптимизировать составы растворов для определенных целей и улучшить эффективность процессов, в которых применяются электролиты.